近日,深圳技术大学药学院助理教授宋莎莎(第一作者)联合上海交通大学医学院附属第一人民医院傅德皓(通讯作者)团队及华中科技大学同济医学院附属梨园医院郭源源(共同第一作者)副教授在国际著名药理学顶级期刊Pharmacology&Therapeutics(IF:12.31)上发表了题为“Advances in pathogenesis and therapeutic strategies for osteoporosis”的综述论文(深圳技术大学为该论文第一完成单位)。

骨质疏松症是指由于骨量减少,骨结构破坏导致骨脆性增加、骨密度减低,骨折风险增高为特征的全身性骨骼疾病。人类的骨骼始终处于一种不断更新的动态平衡中,这个过程主要包括骨形成和骨吸收。当骨吸收大于骨形成则会发生骨量丢失,骨质疏松症随之发生。骨质疏松症发病机制涉及多种致病因素,包括衰老、自噬、铁代谢异常、肠道微生物群和应激等,这些致病因素相互作用形成一个复杂的网络参与骨质疏松症的病理过程。本文重点回顾了近年来骨质疏松症发病机制与治疗策略研究的最新进展以及存在的局限和挑战,同时对新近发现的骨质疏松症治疗潜在靶点(如肠道菌群和细胞衰老)做了深入探讨,为骨质疏松症病理机制和治疗策略的研究提供了重要的理论依据。
骨重建
骨重建是一个涉及骨形成和骨吸收的连续过程。在儿童成长过程中,骨形成超过骨吸收。一旦骨骼成熟,这两个过程速度大致相似。骨重建与众多因素有关,受Wnt信号通路、OPG/RANK/RANKL信号通路、激素(雌激素、降钙素、甲状旁腺激素和雄激素)、饮食(维生素D3和Ca2+)、运动和细胞外基质等因素影响。

图1.骨重建及骨质疏松基本发病机制示意图
骨质疏松病理机制
在绝经后妇女,雌激素缺乏诱导了骨重建失衡,导致骨丢失。除性激素外,细胞衰老、自噬、铁代谢及肠道菌群等因素也影响骨质疏松的病理进程。衰老引起肠道微生物变化、自噬抑制、铁超载,能够通过调节机体免疫、代谢途径、线粒体自噬、p53表达和ROS产生,抑制成骨,促进脂肪形成,从而诱导骨髓间充质干细胞(BM-MSCs)衰老。

图2.老年骨质疏松症中涉及的老化机制
骨质疏松临床药物治疗概况
抗骨质疏松药物按作用机制可分为骨吸收抑制剂、骨形成促进剂、其他机制类药物及中药制剂。


表1.目前常用骨质疏松药物的分类及机制
骨质疏松潜在的治疗策略
益生菌和骨质疏松
益生菌能够改善或恢复肠道菌群,通过多种机制对宿主发挥有益作用。这些机制包括:(1)益生菌通过改变肠道微生物组的组成,增加BMP-2和Sparc的基因表达,从而增加去卵巢(OVX)减少的成骨细胞数量和骨量。(2)益生菌通过调节免疫来减少骨质流失。益生菌可通过降低破骨细胞Th17的比例降低细胞因子如IL-17、IL-6和TNF-α的生成。同时,益生菌可增加抗破骨细胞生成的Treg细胞的比例,增加细胞因子如IL-10、IL-6、TNF-α的生成。(3)益生菌可通过降低肠道通透性和肠道分泌IL-17、RANKL和TNFα来防止OVX诱导的骨丢失,从而抑制破骨细胞的生成。
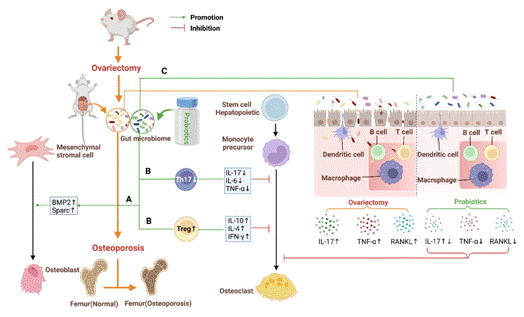
图3.益生菌改变肠道微生物群影响骨重塑和/或骨量的机制(OVX模型)
α-酮戊二酸(AKG)和骨质疏松
AKG是Krebs循环的中间产物,是谷氨酸脱氨生成的酮酸。研究发现,AKG在骨骼的生长和代谢功能的维持中发挥重要作用。AKG可通过使衰老的间充质干细胞活化返青、促进骨组织矿化、抑制破骨细胞活化、促进成骨细胞分化等骨重塑因子改善骨质疏松。除了上述作用外,AKG还被证明可通过调控肠道免疫、肠道菌群和细胞自噬对骨质疏松发挥治疗作用。
抗衰药(senolytics)和骨质疏松
Senolytics是一类选择性消除衰老细胞的药物,旨在减少衰老细胞负担以延长预期寿命和减少与年龄有关的疾病的发病率。根据现有的分子靶点和作用机制,达沙替尼和槲皮素被预测具有潜在的抗衰老能力,因为它们具有暂时使衰老细胞抗凋亡途径(SCAP)网络失效的能力。研究发现,达沙替尼+槲皮素治疗可通过降低破骨细胞的表达,增强皮质内表面成骨细胞的表达以及矿物质的附着和骨形成率,增加股骨皮质的厚度和骨强度,从而导致骨吸收受到抑制,同时维持或增加骨形成。
硫化氢(H2S)和骨质疏松
越来越多的证据表明H2S与骨质疏松发病机制具有相关性。H2S主要通过以下机制参与骨质疏松病理进程。H2S生理水平的维持已被证明是确保细胞间Ca2+稳态所必需的,而正常的H2S水平是通过BM-MSCs中多个TRP通道的硫化实现的。H2S水平的降低将导致BM-MSCs的级联反应,包括Ca2+通道硫酸化、Ca2+内流、Wnt/b-catenin信号和成骨分化的改变,从而导致骨质疏松。而且,H2S、肠道菌群和健康之间的密切关联。本文讨论了肠道菌群失衡在骨质疏松发病机制中的调控作用,探究H2S是否可通过调节肠道菌群的表达和功能来影响骨质疏松发病,为进一步研究作了展望。
论文链接:https://doi.org/10.1016/j.pharmthera.2022.108168
供稿:科研办公室
审核:孙源
